| © I contenuti di questa pagina (escluse le immagini di pubblico dominio) sono di proprietà esclusiva dell'autore Dott.ssa M.Emilia De Leo. Ne è vietata la copia, la riproduzione e l'utilizzo anche parziale in ogni forma. |
Indice degli argomenti
(insulino-dipendente - IDDM)
(non insulino-dipendente - NIDDM)

Diabete mellito tipo 1
(insulino-dipendente - IDDM)Questo tipo di diabete interessa soprattutto bambini, adolescenti e giovani adulti e per tale motivo veniva definito diabete giovanile o insulino- dipendente.
È caratterizzato da una sintomatologia improvvisa, dovuta alla carenza o totale assenza di insulina nell'organismo: i pazienti per vivere hanno necessità di introdurre
giornalmente l'insulina. Questo deficit grave di insulina è causato dalla distruzione a livello del pancreas delle β-cellule, deputate alla produzione di insulina.
Tra le cause della malattia sono importanti gli aspetti genetici. Il rischio di sviluppare il diabete di tipo 1 è del 30-40% nei gemelli monozigoti (gemelli identici), del 5-10% nei fratelli e del 2-5% nei figli.
Agli individui diabetici viene trasmessa geneticamente una errata modalità della risposta del sistema immunitario. Nel diabete tipo 1, il sistema immunitario si attiva per errore verso le β-cellule del pancreas: si formano così anticorpi che attaccano le
preziose cellule β, per cui l'insulina non può più essere prodotta e si scatena la malattia diabetica. Per questo motivo, il diabete di tipo 1 viene classificato tra le malattie autoimmuni.
Sembra che questa attivazione impropria della risposta immunitaria sia scatenata da un fattore esterno, ancora non conosciuto con certezza. I più incriminati sono i virus, come quelli
della parotite (gli "orecchioni"), il citomegalovirus, i virus Coxackie B, i virus dell'encefalomiocardite.
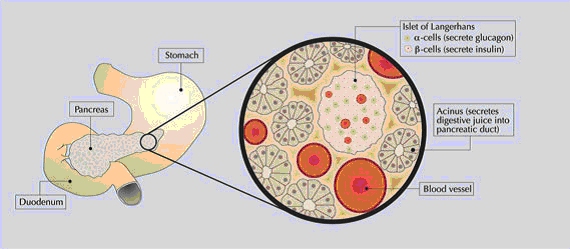
Immagine: Dean Madden
L'insorgere del diabete può manifestarsi in modo molto poco avvertibile:
maggiore affaticabilità, comparsa di prurito specialmente in regione anale e vulvare, aumento della quantità delle urine, una sete non giustificata, frequenti infezioni della pelle e lenta cicatrizzazione delle ferite, dovrebbero consigliare un esame delle urine, alla ricerca dell'eventuale presenza di glucosio.
A uno stadio più avanzato, segni che devono far sospettare il diabete mellito sono: dimagramento, disturbi digestivi, nausea, nevralgie, turbe della vista, crescente affaticabilità , aumento dell'urina prodotta rispetto all'acqua ingerita. Molto importanti sono i segni che denunciano un'alterata circolazione specialmente agli arti inferiori (chiazze livide sulla cute, dolori, alterazioni della sensibilità , ecc.) e la possibilità di una gangrena. A livello dell'apparato genitale importanti sono i segni di impotenza sessuale nel maschio e di alterazioni del ciclo mestruale nella donna.
Diabete mellito tipo 2
(non insulino-dipendente - NIDDM)Questa malattia ha un esordio generalmente più tardivo rispetto al tipo 1, interessando soggetti di 40-65 anni di età . Circa il 40% dei diabetici di tipo 2 ha parenti di primo grado (genitori, fratelli o figli) affetti dalla stessa malattia. Nei gemelli monozigoti la concordanza della malattia si avvicina al 100%.
Il diabete di tipo 2 ha una forte componente ereditaria. D'altro canto si sono rilevati importanti alcuni fattori di rischio di tipo ambientale, quali l'obesità , specie se di alto grado, la sedentarietà , il tipo di dieta (intesa come tipo di alimentazione).

È stata evidenziata una netta una correlazione tra l'incremento del peso corporeo e l'aumentata frequenza della malattia.
Anche la mancanza di attività fisica è stata messa in relazione con la malattia, osservando come soggetti che lavorano in campagna sono più esposti al
diabete quando si trasferiscono in città , dove svolgono attività più sedentarie ed tendono ad aumentare di peso.
La dieta è importante in quanto si è visto che l'assunzione di cibi ad alto contenuto calorico e di veloce digestione e con poche fibre
determinano un assorbimento più rapido ed incrementi maggiori e più repentini della glicemia. Gli zuccheri semplici, contenuti in cibi dolci sono i più pericolosi proprio per
la loro rapidità di assorbimento; le fibre alimentari, invece hanno un effetto protettivo per la loro capacità di ridurre la quantità e la velocità dell'assorbimento degli zuccheri.
Il diabete tipo 2 non è causato da una diminuzione assoluta dell'insulina,
ma da una sua azione difettosa. I valori dell'insulina nel sangue non sono diminuiti in assoluto, anzi possono essere anche più elevati del normale, ma i suoi recettori, non funzionano correttamente. L'ormone cioè non riesce ad attivare le vie metaboliche nelle cellule ed il risultato è che in ogni caso esso si ritrova ad essere comunque in una situazione di deficit relativo: l'insulina che si trova in circolo non è sufficiente a mantenere la glicemia a livelli normali. Questo richiede un super lavoro da parte del pancreas che, quando non è più in grado di secernere una quantità adeguata di insulina, fa sଠche la patologia diabetica inizi a manifestarsi.
La patogenesi dell'insulino-resistenza appare complessa e risulta da una combinazione di difetti genetici e di fattori ambientali. Alcuni dei difetti molecolari, geneticamente determinati, possono
essere considerati il primum movens patogenetico a cui segue una sequenza di alterazioni metaboliche secondarie che concorrono a determinare le molteplici manifestazioni cliniche dell'insulino-resistenza.
In analogia agli oncogeni, questi fattori genetici primitivi potrebbero essere denominati diabetogeni. Accanto a quest'ultimi, alterazioni dell'espressione di altri geni correlati all'insulino-resistenza
potrebbero avere un ruolo rilevante, ma secondario, sulla insorgenza e progressione della malattia. Diverse evidenze suggeriscono che l'insulino-resistenza periferica possa essere il risultato di una
serie di difetti molecolari localizzati a differenti livelli lungo la cascata di eventi cellulari che sottendono all'azione dell'ormone. Finora sono state individuate e caratterizzate a livello molecolare
quasi 100 proteine coinvolte nella risposta biologica all'azione dell'insulina.
La prima tappa dell'azione insulinica è costituita dall'interazione con il proprio recettore presente sulle membrane plasmatiche delle cellule bersaglio. L'interazione tra l'insulina e
il recettore induce una variazione conformazionale a cui consegue la stimolazione dell'attività chinasica della subunità b intracellulare. Questo porta al trasferimento di gruppi fosfati
dall'ATP a diversi residui tirosinici localizzati in discrete regioni del recettore stesso e alla
fosforilazione di substrati endogeni. Una considerevole mole di evidenze suggerisce che l'attività chinasica del recettore costituisca il più importante sistema di trasmissione ed amplificazione del messaggio biologico intracellulare dell'insulina.
 Studi condotti su tessuti bersaglio dell'azione insulinica hanno evidenziato come alterazioni dell'attività chinasica siano presenti sia in soggetti diabetici che nei familiari insulino-resistenti, suggerendo, quindi la possibilità , che alterazioni della cascata fosforilativa del recettore possa essere un evento precoce nello sviluppo della malattia.
Studi condotti su tessuti bersaglio dell'azione insulinica hanno evidenziato come alterazioni dell'attività chinasica siano presenti sia in soggetti diabetici che nei familiari insulino-resistenti, suggerendo, quindi la possibilità , che alterazioni della cascata fosforilativa del recettore possa essere un evento precoce nello sviluppo della malattia.
Inoltre, questa stessa cascata di eventi fosforilativa sembra indurre la fosforilazione di proteine nucleari che regolano l'espressione di altre proteine enzimatiche insulino-dipendenti.
L'azione dell'insulina sul trasporto di glucosio coinvolge la traslocazione di proteine carrier, chiamate trasportatori, dal compartimento intracellulare alle membrane plasmatiche e la successiva attivazione dei trasportatori traslocati sulla superficie cellulare.
I trasportatori di glucosio rappresentano una famiglia di proteine con 5 differenti isoforme tessuto-specifiche denominate GLUT. L'isoforma insulino-sensibile, presente nei due principali organi bersaglio, muscolo e tessuto adiposo, é il GLUT 4. È stato ipotizzato che alterazioni quantitativi o qualitativi del GLUT 4 possano contribuire alla patogenesi dell'insulino-resistenza. Gli studi sull'espressione dell'mRNA del GLUT4 nel tessuto adiposo hanno dimostrato una riduzione dei livelli di questo trasportatore nei pazienti diabetici tali da giustificare la ridotta responsività del tessuto all'azione dell'ormone. Al contrario, la maggior parte degli studi non ha evidenziato una riduzione dei livelli di mRNA del GLUT4 nel muscolo scheletrico di pazienti diabetici. È noto che il muscolo contribuisce per circa l'80% al consumo periferico di glucosio insulino-dipendente. Pertanto, l'insieme delle osservazioni riportate suggerisce che altri difetti quali alterazioni della traslocazione, della fusione dei trasportatori con le membrane plasmatiche o dell'attivazione dei trasportatori sulla superficie cellulare siano responsabili del ridotto trasporto di glucosio osservato in vivo e in vitro nel NIDDM. Sebbene il ruolo patogenetico di questi trasportatori sia stato indagato in condizioni di insulino-resistenza non é stato finora condotto uno studio sistematico della loro espressione in più tessuti insulino-responsivi correlato con l'espressione delle due isoforme del recettore insulinico e con l'espressione dell'IRS-1.
L'osservazione che in tutti i familiari di pazienti diabetici ad alto rischio di malattia é presente un'alterazione dell'attività della glicogeno-sintetasi e della sua fosfatasi specifica, suggerisce che un difetto di questo sistema enzimatico rappresenti uno degli eventi iniziali nella patogenesi dell'insulino-resistenza.
Diabete e complicanze
Aterosclerosi, cioè un ispessimento ed indurimento della parete arteriosa caratterizzato dalla deposizione di lipidi. Per questo motivo i diabetici sono a rischio per coronaropatie, disturbi ischemici cerebrali, insufficienza arteriosa degli arti.
Retinopatia diabetica, alterazione dei capillari a carico della retina.
Nefropatia diabetica, alterazione dei capillari a carico dei reni.
Neuropatia diabetica, sofferenza del sistema nervoso periferico che si manifesta con crampi e disturbi della sensibilità , ma può colpire anche il sistema nervoso vegetativo con disturbi diffusi ai vari organi interessati.
Ulcera diabetica, comparsa di ulcere agli arti inferiori.
Aumentata suscettibilità alle infezioni, ad esempio cistiti, vaginiti ecc.
Diabete ed Esami di Laboratorio
Il primo semplice esame da eseguire è la glicemia a digiuno. Se il valore oltrepassa i 126 mg/dl, in misurazioni ripetute, in giorni diversi si può fare diagnosi di diabete. Se il valore è compreso tra 110 e 126 mg/dl, è necessario approfondire l'indagine con ulteriori esami. Il più comunemente utilizzato è il test di tolleranza al glucosio (carico orale di glucosio), un esame che permette di valutare la capacità dell'organismo di contenere la glicemia entro limiti nomali dopo la somministrazione di un carico orale di glucosio di 75 g (dose standard). Come abbiamo detto, l'indicazione principale per effettuare una curva da carico orale di glucosio è una glicemia compresa tra 110 e 126 mg/dl, ma esistono anche altre condizioni in cui è il caso di indagare approfonditamente per l'esistenza di altri fattori di rischio: familiarità , obesità , soggetti giovani con manifestazioni neurologiche, aterosclerotiche, coronariche, retinopatiche di cui non sia chiara la causa.
Il dosaggio dell'insulina (insulinemia) è un altro esame molto importante in quanto permette di stabilire direttamente la funzionalità delle cellule beta del pancreas. La misurazione effettuata durante il test di tolleranza al glucosio ci fa vedere "dal vivo" la capacità dell'organismo di produrre insulina circolante sotto lo stimolo indotto dal glucosio. Il medico, attenendosi ai criteri riconosciuti dall'OMS (Organizzazione Mondiale della Sanità ), potrà interpretare i risultati combinati di glicemia ed insulina, indicando lo stato di normalità , una ridotta tolleranza al glucosio o la presenza di diabete mellito conclamato.
Un'altra indagine di facile realizzazione e che può essere effettuata anche dallo stesso paziente è l'esame delle urine. Con esso è possibile identificare la presenza di glicosuria (glucosio nelle urine) e chetonuria (presenza di corpi chetonici nelle urine). Se vi è glucosio nelle urine significa come già detto che la glicemia è oltre i 180 mg/dl perché solo oltre questa concentrazione il rene elimina il glucosio con le urine (soglia renale per il glucosio). La glicosuria deve essere effettuata nell'arco della giornata tra un pasto e l'altro, per scoprire eventuali aumenti della glicemia che non siano evidenti a digiuno ma solo dopo i pasti. La chetonuria è sempre espressione di un grave scompenso metabolico.
Il peptide C è un frammento della molecola originale dalla quale si forma l'insulina. Come si vede nella figura sotto, quando dalla molecola iniziale si produce l'insulina vera e propria viene rilasciato anche il peptide C.
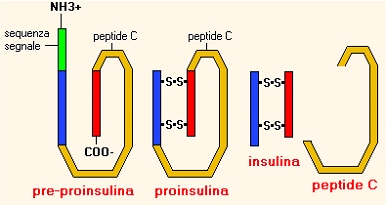
Sequenza di attivazione dell'insulina e rilascio del peptide C Dalla molecola della pre-proinsulina si distacca prima il peptide segnale, poi si formano i ponti disolfuro (S-S) tra due sequenze peptidiche (proinsulina). Tutto il frammento intermedio tra le due catene legate dai ponti disolfuro, il peptide C, si distacca e resta la molecola di insulina attiva.
Nei pazienti che fanno terapia con insulina, per verificare la capacità secretoria delle cellule
beta non possiamo valutare direttamente l'insulinemia, perchè verrebbe misurata anche quella
somministrata come farmaco. Possiamo allora valutare la concentrazione di peptide C (che non è
contenuto nell'insulina farmacologica), specie nei pazienti affetti da diabete mellito di recente
insorgenza, per verificare la capacità residua delle cellule beta di produrre insulina endogena.
Quadro Anticorpale
Dal momento che nel diabete di tipo 1 in fase di esordio si ha spesso la formazione di anticorpi contro vari elementi in causa nella malattia diabetica (cellule beta del pancreas, insulina) si utilizzano test per svelare nel sangue alcuni di questi anticorpi. Questi esami sono effettuati di solito per diagnosticare la fase iniziale del diabete di tipo 1 o per individuare soggetti a rischio di sviluppare questo tipo di diabete.
Questi anticorpi sono presenti in più del 95% dei casi di diabete di tipo 1 in fase iniziale e tendono poi a ridursi sino alla loro scomparsa. Si tende ad attribuire a questi anticorpi un ruolo predittivo della comparsa di diabete: è stato visto che il 50% dei parenti di primo grado (genitori, fratelli, figli) di soggetti con diabete e portatori di anticorpi ICA hanno sviluppato il diabete entro 9 anni dalla loro evidenziazione. Il valore predittivo è ancora più alto (63%) se i soggetti avevano nel sangue anche anticorpi anti-insulina (IAA).
Questi anticorpi possono comparire in circolo prima dell'esordio clinico del diabete e sono associati
ad un elevato rischio di malattia nei parenti di primo grado di soggetti con diabete di tipo 1.
Presentano una correlazione inversa sia con l'età sia con la durata della fase preclinica:
più elevati sono i livelli di IAA, più rapida sembra essere la progressione verso la
malattia, per tale motivo sono un valido marker di predizione della malattia solo in soggetti di
età inferiore ai 10 anni. È stata osservata un'associazione significativa tra
positività autoanticorpale e presenza di HLA DR4.
Questi anticorpi IAA sono importanti per due ordini di motivi. Innanzitutto, sono stati riscontrati
in molti soggetti considerati a rischio per il diabete e tale riscontro è spesso parallelo a
quello degli ICA descritti precedentemente, aumentando il fattore di rischio per la malattia. Inoltre
essi erano alla base di difficoltà terapeutiche quando si utilizzava insulina non di sintesi.
La somministrazione di insulina induceva la formazione di questi anticorpi che si legavano ad essa e
ne bloccavano l'azione. Poteva però accadere che l'insulina, imprevedibilmente, si liberava da
questo legame e poteva indurre crisi ipoglicemiche, in qualunque momento della giornata.
Questi anticorpi si rendevano quindi responsabili di una grave instabilità della malattia.
Con l'avvento dell'insulina ricombinante di sintesi, identica a quella umana, questi anticorpi
reattivi sono scomparsi.
Questi anticorpi sono più sensibili e più specifici rispetto agli ICA. Nell'uomo esistono due isoforme di GAD, che differiscono tra loro per peso molecolare (65kD e 67kD), per derivazione genica e per distribuzione tissutale. La GAD65 rappresenta l'isoforma predominante nelle isole pancreatiche, nelle quali è espressa sia dalle cellule a sia dalle cellule b e sembra localizzata a livello delle microvescicole sinaptiche. Essa è codificata da un gene situata nel cromosoma 2 e presenta un'omologia del 65% con la GAD67. Autoanticorpi antiGAD 65 ed antiGAD67 sono stati riportati nei soggetti sia prima sia ala momento della diagnosi di diabete, tuttavia la GAD65 sembra rappresentar l'isoforma dominante.
Sono stati dimostrati in soggetti con diabete di tipo 1 prima ed al momento dell'esordio clinico della malattia, sono autoanticorpi che reagiscono con due proteine insulari di 37kD (IA2) e di 40kD (IA2b). Sono altamente predittivi di futura comparsa della malattia in parenti di 1º grado di soggetti con diabete di tipo 1.
L'emoglobina glicosilata è un parametro molto utile per valutare il controllo glicemico del paziente. Infatti, mentre la glicemia ci da' una fotografia "istantanea" della situazione glicemica, l'emoglobina glicosilata è come un "film" che indica se la glicemia è stata ben controllata nei 3 mesi circa precedenti. Questa misurazione si basa sul seguente principio: l'emoglobina, che serve a trasportare l'ossigeno ai tessuti, è contenuta nei globuli rossi, i quali hanno una vita media di 120 giorni. Quando nel paziente diabetico la glicemia si eleva, una parte del glucosio si lega irreversibilmente all'emoglobina (glicosilazione) formando appunto emoglobina glicosilata (HbA1). Questa forma di emoglobina è stabile, fino a quando i globuli rossi non completino il loro ciclo vitale e siano distrutti. Diciamo che in questa proteina, in caso di aumento della glicemia, resta una "traccia" indelebile di quanto è avvenuto. Quindi l'HbA1 è un indice fedele del controllo metabolico che nei diabetici non deve essere superiore al 6-7%.
Glossario wiki
| C-peptide Emoglobina glicosilata HbA1c Proteine carrier NIDDM GLUT mRNA Insulina Chinasi Membrana plasmatica β-cellule GAD IRS1 Crisi ipoglicemiche |